 2024-05
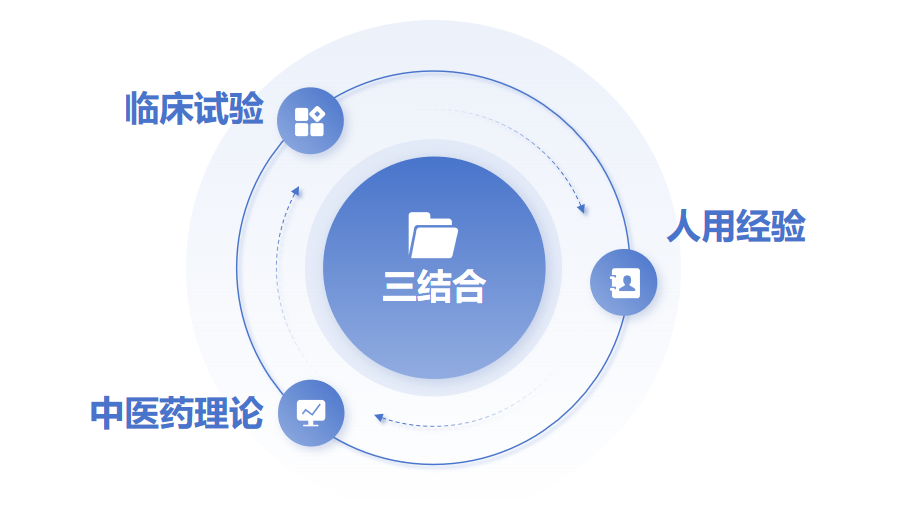
2024-052019年10月20日国务院发布了《关于促进中医药传承创新发展的意见》[1],要求加快构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系(以下简称“三结合”),完善符合中医药特点的技术标准,促进中药新药研发上市。
非临床研究对于中药创新药的临床试验申请(IND)的获益-风险评估具有不可替代的作用,所以中药复方制剂IND申请之前需根据品种的特点和临床定位,完成必要的药效学研究和毒理学研究。
一、中药不同注册分类的非临床研究要求
根据国家药监局关于发布《中药注册分类及申报资料要求》的通告(2020年第68号)[2],中药注册的分类有以下:

根据国家药监局关于发布《中药注册管理专门规定》的公告(2023年第20号)[3],中药不同注册分类的非临床研究要求:
1、中药创新药
1.1中药复方制剂
根据其处方来源及组成、人用安全性经验、安全性风险程度的不同,提供相应的毒理学试验资料。
l 对于采用传统工艺,具有人用经验的,一般应提供单次给药毒性试验、重复给药毒性试验资料。
l 对于采用非传统工艺,但具有可参考的临床应用资料的,一般应提供安全药理学、单次给药毒性试验、重复给药毒性试验资料。
l 临床试验中发现非预期不良反应时,或毒理学试验中发现非预期毒性时,应考虑进行追加试验。
1.2提取物及其制剂
根据其临床应用情况,以及可获取的安全性信息情况确定其毒理学试验要求。
l 如提取物立题来自于试验研究,缺乏对其安全性的认知,应进行全面的毒理学试验。单一成分,参照化学药
l 如提取物立题来自于传统应用,生产工艺与传统应用基本一致,一般应进行安全药理学试验、单次给药毒性试验、重复给药毒性试验,以及必要时其他可能需要进行的试验。
1.3新药材及其制剂
应进行全面的毒理学研究药理毒理开发。
2、中药改良型新药
根据CDE发布的《中药改良型新药研究技术指导原则(征求意见稿)》[4],应以临床价值为导向,围绕临床应用优势和特点进行研发。应当根据变更情况提供相应的毒理学试验资料。
2.1增加功能主治
l 延长用药周期或者增加剂量者,应当提供非临床安全性研究资料。上市前已进行相关的非临床安全性研究且可支持其延长周期或者增加剂量的,可不进行新的非临床安全性试验。
2.2改变剂型
l 基于有效性的改良:根据改良的具体情况考虑开展非临床安全性试验。
l 基于安全性的改良:如果改良涉及生产工艺、辅料等改变引起药用物质基础或药物吸收、利用明显改变,应进行相关的非临床安全性对比试验。另外,如果被改良中药上市前及上市后均未进行相关的毒理研究,且在应用过程中存在明显安全性担忧的,如含毒性药味或现代研究发现有明显毒性的药味、临床上出现严重不良反应,应考虑进行相关的毒理试验。
2.3改变途径
l 因改变给药途径可能伴随着工艺变化导致物质基础或吸收部位的变化,通常应按照中药新药的相关要求开展研究。
2.4已上市中药生产工艺或辅料等改变引起药用物质基础或药物吸收、利用明显改变的
l 应当以提高有效性或改善安全性等为研究目的开展相应研究
3、古代经典名方中药复方制剂
根据CDE发布的关于公开征求《古代经典名方中药复方制剂毒理学研究技术指导原则》意见的通知[5],申请古代经典名方中药复方制剂上市许可申请,非临床安全性研究资料是必要资料之一。
一般情况下,包括单次给药毒性试验、重复给药毒性试验。另外,根据品种具体情况,必要时需提供其他毒理学试验。例如,若毒理学试验中发现非预期毒性时,应考虑进行追加试验;若临床应用涉及特殊人群或已有信息(包括已有的试验结果和文献资料)显示存在特殊安全性担忧,需根据具体情况开展相应的毒理学试验。
4、同名同方药
根据国家药审中心发布的《同名同方药研究技术指导原则(试行)》的通告(2022年第48号)[6],有以下情形:
l 基于工艺参数、辅料与对照药对比情况确定是否需进行毒理和临床试验。相同的或经评估不引起起药用物质基础或药物吸收、利用明显改变的,可不进行。对照药关键工艺参数不明显;变化对药用物质基础或药物吸收、利用的影响难以评估的,一般需进行。如发生明显改变的需进行研究。
l 另外,如果对照药上市前及上市后均未进行相关的毒理研究,且在应用过程中存在明显安全性担忧的,如含大毒(剧毒)药味或现代研究发现有严重毒性的药味、临床上出现严重不良反应,应当考虑进行相关的毒理试验。
l 对于中药复方制剂,毒理试验项目一般包括单次给药毒性试验、重复给药毒性试验,必要时根据具体情况进行其他毒理试验。
二、中药非临床安全性研究的审评关注点
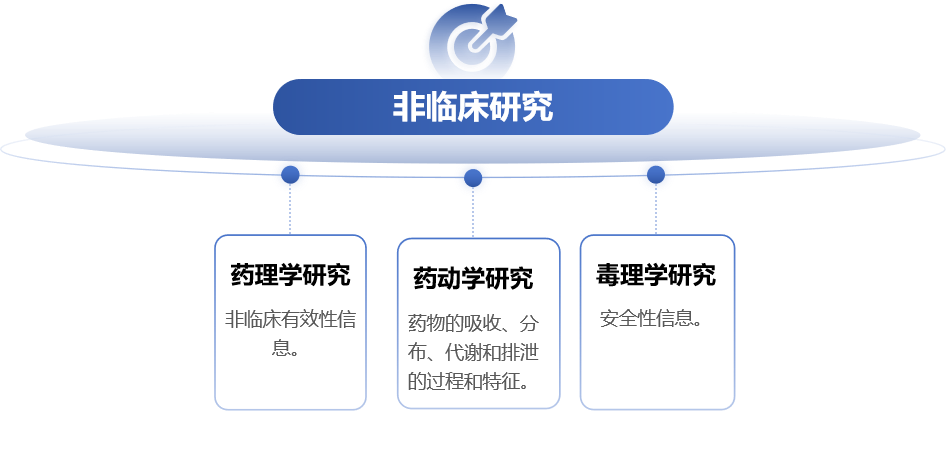
参考《中药注册申报中非临床研究资料常见问题探讨》[7]、《中药复方制剂临床试验申请的非临床研究关注要点》[8],一般情况下,安全药理学、单次给药毒性、支持相应临床试验周期的重复给药毒性、遗传毒性试验资料、过敏性、刺激性、溶血性试验资料或文献资料应在申请临床试验时提供。后续需根据临床试验进程提供支持不同临床试验给药期限或支持上市的重复给药毒性试验。生殖毒性试验根据风险程度在不同的临床试验开发阶段提供。致癌性试验资料一般可在申请上市时提供。
应根据给药途径、制剂情况、临床应用情况、品种具体情况等提供相应的毒理学研究。毒理学研究资料应列出试验设计思路、试验实施过程、试验结果及评价。
1、试验设计
在中药注册申报资料中,安全药理学试验设计常见问题有:
1)犬心血管系统试验中采用麻醉犬进行,麻醉会造成动物的心率、呼吸频率、血压和QT间期发生变化,动物间麻醉深度不一致会对结果评价造成影响。
2)剂量不符合要求,安全药理学剂量应包括和高于主要药效学或治疗剂量范围。如果设计剂量过高,在毒性剂量范围内的某些作用(如在记录心电图的过程中,出现的震颤或自发性收缩)可能会混淆对结果的解释,剂量过低则可能未达到药效剂量下的暴露量而未暴露相关毒性风险。
3)安全药理学试验整合于重复给药毒性试验中,但是仅按照常规的重复给药毒性试验的临床症状观察、心电图指标的观察,未进行专门的设计,其检测指标、检测方法、检测时间点达不到安全药理学试验的要求,导致无法获得有效的安全药理学信息。安全药理学试验设计的具体要求可参考我国2014年发布的《药物安全药理学研究技术指导原则》[9]。
其他试验设计问题包括给药频率不符合要求、实验动物数和年龄不符合要求、给药方案未能真实模拟临床应用情况等。
2、试验过程
2.1受试物
受试物应具有代表性,质量应稳定、均一、可控,能体现临床试验用样品及申请上市样品的质量属性和安全性。应以确定的处方、工艺制备受试物,受试物应为中试及以上规模的样品。古代经典名方制剂应采用药学研究确定生产工艺后的样品作为受试物若为提高毒理学试验中的给药剂量等试验需要,需要采用浸膏、浸膏粉等中间体作为受试物,应说明其代表性。如果辅料、剂型对药物的吸收利用影响较大或为特殊给药途径的,应采用含辅料制备的受试物进行毒理学试验,应考虑受试物中浸膏和辅料比例等因素可能对试验结果的影响。
可参考《中药新药毒理研究用样品研究技术指导原则(试行)》[9]有关要求。
2.2重复给药毒性试验
根据2014年发布的《药物重复给药毒性研究技术指导原则》[9]要求,给药期限如下:
支持药物临床试验 | ||
最长临床试验期限 |
重复给药毒性试验的最短期限 |
|
啮齿类动物 |
非啮齿类动物 |
|
≤2周 |
2周 |
2周 |
2周~6个月 |
同临床试验 |
同临床试验 |
>6个月 |
6个月 |
9个月 |
支持药品上市申请 | ||
临床拟用期限 |
啮齿类动物 |
非啮齿类动物 |
≤2周 |
1个月 |
1个月 |
2周~1个月 |
3个月 |
3个月 |
1个月~3个月 |
6个月 |
6个月 |
>3个月 |
6个月 |
9个月 |
注:
1、非啮齿类动物不超过6个月期限的试验可接受情况:当免疫原性或耐受性问题使更长期限的试验难以进行时;重复、短期用药(即便临床试验期限6个月以上)的疾病,如偏头痛、勃起障碍、单纯性疱疹等的反复间歇给药时;拟用于危及生命的疾病(如进展性疾病、辅助使用的肿瘤化疗药)时。
2、如果儿童为主要拟用药人群,而已有毒理学或药理学研究结果提示可能发生发育毒性,应考虑在幼年动物上进行长期毒性试验。该试验应采用合适年龄和种系的动物,试验观察指标应针对发育方面的毒性,试验期限犬12个月、大鼠6个月。12个月的犬试验期限应涵盖其发育的全过程。这些幼年动物的长期试验可用于替代标准的长期毒性试验和单独的幼年动物试验。
3、试验结果分析
试验结果分析方面主要包括(但不限于)以下问题:
1)有些资料将所有的试验结果罗列,而未对结果进行受试物相关性分析,或判断为无毒理学意义,但未提供充分的判定依据或判断标准。例如,有些品种认为变化幅度小,在正常值或背景值范围内,但是未提供正常值或背景值范围及其来源。某品种试验过程中出现部分动物死亡,申请人判断为与给药无关,但又未提供这些死亡动物的具体情况,也无组织病理学检查结果,导致无法判断动物死亡与受试物的相关性。
2)缺乏与临床相关性的分析。例如,某拟用于慢性胃炎的品种,大鼠26周重复给药试验中在试验末期低、中剂量组均有恶性血液肿瘤发生,但未提供机构大鼠出现该肿瘤发生的背景数据,也未提供充分的证据排除与受试物的相关性和临床相关性,申请人解释说明后仍不能排除相关风险。审评认为该品种在低、中剂量下出现的恶性肿瘤,不明确与受试物的相关性和临床相关性,对于慢性胃炎患者不可接受这种潜在的风险,故未批准该品种开展临床试验。又如,某品种SD大鼠重复给药毒性试验中出现无剂量相关性的大鼠慢性进行性肾病,主要见于雄性大鼠,但是申报资料并未对其进行分析,后经申请人/试验者结合各项指标进行综合分析,认为该病变属于雄性SD大鼠特异性疾病,与临床相关性不强。
3)未结合品种的特点对毒理学试验中的毒性结果进行针对性的分析。由于中药毒性可能与其处方组成有关,许多中药药味毒性比较明确,如何首乌的肝毒性、乌头类中药的心脏毒性等,如果所含药味的中药出现相关的毒性反应,应该结合处方组成、配伍和饮片炮制等情况进行分析,为临床安全用药提供依据。当毒理学试验中出现了与处方中药材特点不相符而又难以解释的毒性反应时,需考虑毒性是否与所采用的制备工艺有关等。
本文参考资料:
[1]中共中央国务院:《关于促进中医药传承创新发展的意见》,2019.
[2]NMPA:关于发布《中药注册分类及申报资料要求》的通告(2020年第68号),2020.
[3]NMPA:关于发布《中药注册管理专门规定》的公告(2023年第20号),2023.
[4]CDE:《中药改良型新药研究技术指导原则(征求意见稿)》,2023.
[5]CDE:关于公开征求《古代经典名方中药复方制剂毒理学研究技术指导原则》意见的通知,2021.
[6]CDE:《同名同方药研究技术指导原则(试行)》的通告(2022年第48号),2022.
[7]周植星,黄芳华.中药注册申报中非临床研究资料常见问题探讨[J].中草药,2022,53(15):4905-4914.
[8]周植星,李寅超,黄芳华.中药复方制剂临床试验申请的非临床研究关注要点[J]中草药,2023,54(21):6933-6939.
[9]NMPA:《关于发布药物安全药理学研究技术指导原则等8项技术指导原则的通告(第4号)》,2014.








