 2024-10
2024-10根据ICH及GMP的定义,偏差(Deviation)是指偏离已批准的程序或规定标准的任何情况。是在产品生产、检验、包装或贮存过程中发生的任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况。它包括药品生产的全过程(运输、贮存、生产、检验)中涉及的各种影响因素。
偏差的分类有多种形式,在实际处理过程中,我们可以综合考虑各种因素对其进行分类。根据偏差对药品质量产生影响程度的大小,可以将偏差分为微小偏差、一般偏差、重大偏差。根据偏差的使用范围又可以分为生产偏差、检验偏差和物料偏差。根据对偏差产生的结果分析,又可以分为OOS(out of specification)和OOT(out of trend)。OOS是指在检验过程中出现的任何偏离标准(包括国家标准、地方标准和企业内部标准)的结果;OOT是指通过追溯生产过程中的记录和数据,得出的某一参数的系统趋势,从而制定出此项参数的正常波动范围,如果超出此范围,但在标准规定以内即为OOT。
不同企业因事务流程、组织架构、责任分配等不同的环境条件,会有不同的偏差处理调查流程,但至少包含以下几个要素:偏差识别、偏差调查、纠正和预防措施、纠偏结果评价和偏差记录(或偏差报告)。
一、偏差的识别
偏差识别是偏差处理的起点,在大多数偏差处理过程中,偏差被识别和报告的时机直接决定了偏差的影响程度和偏差根本原因的调查难度,也直接影响了纠偏措施的工作量和工作难度,因此如何更快、更及时地识别并报告偏差至关重要。为了使偏差更快、更及时地被识别并报告,所有药品生产和质量相关人员(特别是一线操作人员和QA现场检查人员)均应接受偏差管理程序的培训,使其理解偏差概念并具备识别偏差的能力。例如:
① 使用物料之前确认是否经过放行;
② 在使用物料之前检查物料标识的完整情况及是否正确;
③ 使用设备之前检查设备状态;
④ 投料过程中确认投料量是否正确;
⑤ 收率是否超过设定值。
二、偏差调查
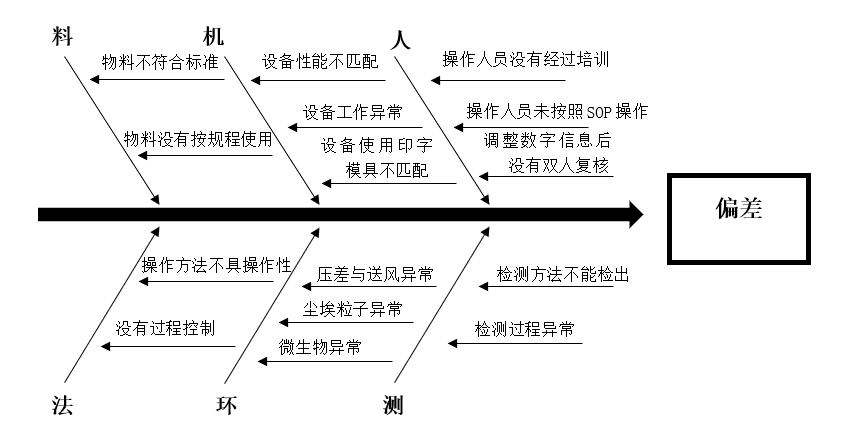
偏差调查可运用头脑风暴法、鱼骨图法、5WHY法或失效模式与影响分析法(FMEA)等调查工具,从人、机、料、法、环等因素进行偏差原因的调查分析。下面将举例简述鱼骨图法和FMEA在偏差处理流程中的应用。
举例:某产品201806049批次外包装过程中现场QA人员发现有产品的标签上批号为201809049,立即上报偏差管理员,启动偏差处理程序,暂停包装,排查本批次所有已包装和未包装产品,共计发现8705支产品标签批号错误。
原因调查:绘制鱼骨图分别从人、机、料、法、环、测逐一调查,得出贴标工位操作人员在贴标过程中发现批号中数字“6”不够清晰,停机拆卸印字模具并清洗,安装模具时将数字“6”倒装,导致批号打印错误。而导致这一错误的根本原因是贴标过程中调整数字信息后没有双人复核。
风险赋值:依据风险发生后结果的严重性(S)、风险发生的可能性(P)、风险发生时的可检测性(D)3个方面综合评估,并赋予分值,评定标准可见表1、表2、表3。严重级别(S):因产品批号错误,可能导致患者使用该产品时产品已过有效期,可能导致顾客健康受到伤害,S=4;可能性(P):因调整贴标机字模失败才会导致错误发生,该错误很少发生,P=2;可检测性(D):贴标或包装工位操作人员周期性检查贴标质量可以发生错误,D=3。
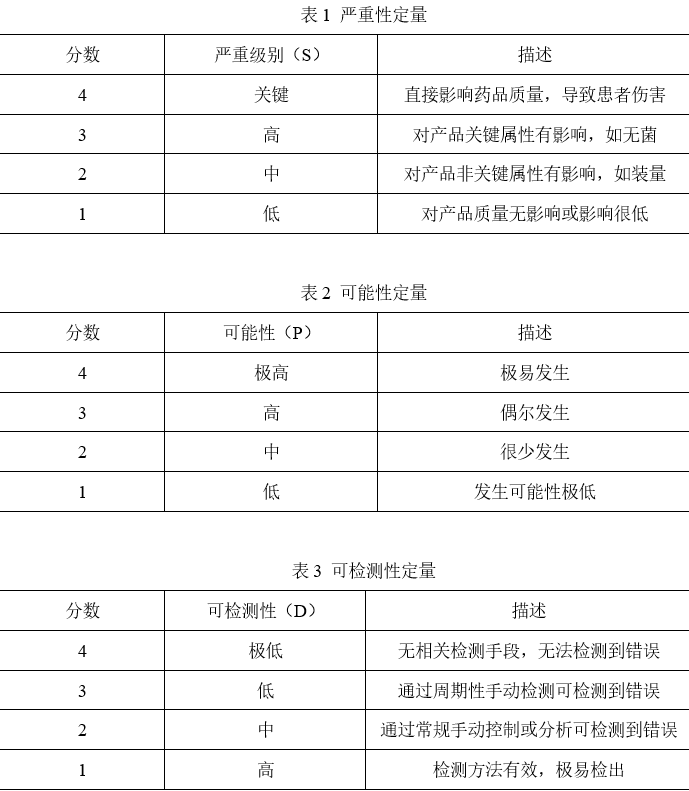
风险级别确定:风险优先系数(Risk Priority Number,RPN)是事件发生的严重性(S)、可能性(P)和可检测性(D)三者乘积,用来衡量可能的缺陷,其数字越大风险级别越高。计算公示:RPN=S*P*D,评估结果评定见表4。根据RPN计算公示,RPN=S*P*D=4*2*3=24>16,风险级别为高,偏差为重大偏差,必须采用进一步控制措施降低风险至可接受水平。

三、 纠正与预防措施
顾名思义,纠正与预防措施包括偏差的纠正措施及预防措施,是偏差处理活动的主要环节,它的执行程度也决定了偏差的解决程度。
纠正措施是为了消除已发现的不合格(偏差)或其他不期望情况的根源所采取的措施。常见的纠正措施包括降级、返工、销毁、重新包装、重新贴签等。为了防止偏差的不良影响进一步扩大,制定相应的纠正措施:①立即停止贴标及包装操作,将批号错误的产品全部挑出,清点数量进行隔离并做好标识;②揭除错误标签,如不影响产品质量的可重新贴标,若可能影响产品质量则需要销毁;③将贴标机的数字信息更正为正确的,双人复核,QA人员确认无误后开始贴标操作。
预防措施是为了消除潜在不合格(偏差)或其他不期望情况的原因所采取的措施。常见的预防措施包括修订文件、重新培训、改进相关系统等。为了降低风险级别,防止偏差再次发生,可从降低偏差发生的可能性、提高错误的可检测性着手,制定措施:①修订贴标标准操作程序(SOP),增加贴标过程中如需调整数字信息,调整后必须由另一人复核再经QA人员复核,无误后方可继续贴标;②贴标机技术升级,增加视觉检查功能,设备可逐瓶自动检查贴标质量并剔除不合格品。
制定相应的纠正与预防措施(CAPA)后也可采用FMEA法对其有效性进行风险评估。如严重级别(S):因产品批号错误,可能导致患者使用该产品时产品已过有效期,可能导致顾客健康受到伤害,错误的严重级别不会改变,S=4;可能性(P):因修改了贴标SOP,增加了双人复核,QA人员确认的过程,发生可能性极低,P=1;可检测性(D):因设备进行了技术升级,增加了自动检查功能,自动控制装置到位,检测错误时能够报警提示并剔除,D=1。根据RPN计算公式,RPN=S*P*D=4*1*1=4<7,风险级别可降为低,次风险水平可接受,可批准实施CAPA。
四、纠偏结果评价
严格按照制定的CAPA实施后,实施效果良好,可批准关闭偏差。
偏差关闭后每年进行质量评估,可采用FMEA法评价偏差处理效果。如严重级别(S):因产品批号错误,可能导致患者使用该产品时产品已过有效期,可能导致顾客健康收到伤害,S=4;可能性(P):因修改了贴标SOP,增加了双人复核,QA人员确认的过程,从该偏差发生至此次评估时段内,没有再发生类似事件,发生可能性极低,P=1;可检测性(D):设备自动检测功能通过验证,检测能力能达到预期效果,D=1。根据RPN计算公式,RPN=S*P*D=4*1*1=4<7,风险级别为低时,可认为偏差处理及纠正与预防措施实施有效。
总而言之,药品的质量是企业的生命,偏差管理作为一种发现问题,分析问题、解决问题并持续改进质量管理体系的有效手段,对提升质量管理理念、提高质量改进的执行力具有重大的意义。任何一个企业生产过程中出现问题是在所难免的,关键是要及时的发现并得到有效的处理,不逃避问题,正视生产过程中的偏差,确保偏差得到及时调查分析,正确处理,纠正预防措施到位,规避潜在质量风险。








