 2024-08
2024-08(一)前言
自2016年《保健食品注册与备案管理办法》实施以来,保健食品的注册审批工作进展缓慢,2018年仅有10款保健食品注册获批。2019年审批速度虽然加快,但仍有许多2015年前申报的新产品未获得批准,2020年至2021年审批速度又有所放缓。此外,《保健食品检验与评价技术规范》(2003版)废止后,久久未公布新的功能检验与评价技术指导原则和方法,企业在产品研发过程中功能评价无法可依,企业研发工作难以开展,也降低了企业创新的积极性。虽然,2019年国家发布《保健食品原料目录与保健功能目录管理办法》,允许研发主体开展新原料和新功能的研究,但缺乏相关指导性文件,行业反映无法开展相关研究工作。
2023年6月,国家市场监督管理局发布了营养补充剂、大豆分离蛋白和乳清蛋白的3个保健食品原料目录,并明确了营养补充剂允许宣传的保健功能,这无疑增大了市场信心。同年8月,更是明确了非营养补充剂允许宣传的保健功能,并发布了《保健食品功能检验与评价技术 指导原则(2023年版)》、《保健食品功能检验与评价方法(2023年版)》、《保健食品人群试食试验伦理审查工作 指导原则(2023年版)》3个配套文件,政策利好保健食品注册。
表1为保健食品的自2014年至2024年的注册(含再注册、转让、新注册等)数量:
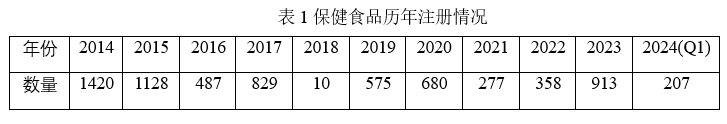
从表1可知, 10年前是保健食品注册获批的高峰期,随着申报数量的增多以及政策的收紧,获批数量总体是逐年减少的。而2023年的新政策无疑刺激了保健食品注册的热情,本文旨在通过评估小试、生产、质量研究、注册阶段的时长,为即将启动保健食品注册研发的同行做个参考。
(二)小试、生产、质量研究阶段时间预估
1、小试阶段时间
小试阶段,液体保健品主要考察指标在于适口性试验,固体保健品主要考察指标在于脆碎度、崩解时限等等,确定配方及工艺后,可针对关键物料属性进行配方考察,针对关键工艺参数进行工艺考察,考察方式包括不限于单因素考察、正交试验或曲面相应法等。根据各品种的难度,研发时间大概在2个月~6个月。
2、中试生产时间
根据不同制剂的放大效应,进行1~3批的中试进行工艺的调整,进行功效成分或标志性成份的检测分析方法学的验证(如果主成分无法定标准,所开发的检测分析方法也需要进行方法学验证)。根据调整得到的工艺参数,进行连续3批中试生产,同步进行清洁验证。根据各品种的难度,研发时间大概在2个月~6个月。
3、质量研究阶段
根据审评中心对于功能学(即功效学)评价试验先后顺序的要求[1]:人体试食试验必须在卫生学试验、动物毒理学安全性试验及兴奋剂检测(仅限缓解体力疲劳、促进生长发育、减肥功能)完成之后,确定试食产品是安全的并符合有关卫生标准要求的情况下再进行。
因此质量研究阶段的研究顺序是:稳定性试验(含卫生学检验)、毒理学试验、功效学试验。
所得的连续3批中试产品委托第三方有资质的机构进行全检以及稳定性试验的检验,其中加速稳定性考察3个月,长期稳定性考察至预设保质期。在完成加速、长期稳定性考察3个月后,即可开展毒理学试验和功效学试验, 时间8~10个月。
(三)保健食品注册受理、审评、审批时间
根据《保健食品注册与备案管理办法》[2]、《保健食品注册申请服务指南(2016版)》[2]、《保健食品注册审评审批工作细则(2016年版)》[3]和《使用保健食品原料目录以外原料和首次进口的保健食品(除属于补充维生素、矿物质等营养物质外)注册实施规范(基本要素)》[4],保健食品注册的注册时有关审评时限的条文如下:
1、受理阶段:
①资料完整性检查时限:受理机构收到申请材料后,申请材料不齐全或者不符合法定形式的,应当当场或者在5个工作日内一次告知注册申请人需要补正的全部内容。
②资料移交时限:受理机构应当在受理后3个工作日内将申请材料一并送交审评机构。
2、审评阶段
①审评时限
审评机构应当组织审评专家对申请材料进行审查,并根据实际需要组织查验机构开展现场核查,组织检验机构开展复核检验,在60个工作日内完成审评工作,并向国家市场监督管理总局提交综合审评结论和建议。特殊情况下需要延长审评时间的,经审评机构负责人同意,可以延长20个工作日,延长决定应当及时书面告知申请人。
②现场核查、复核检验时限
依法进行现场核查、复核检验、复审另需时间不计算在该时限。
审评机构认为需要开展现场核查的,应当及时通知查验机构按照申请材料中的产品研发报告、配方、生产工艺等技术要求进行现场核查,并对下线产品封样送复核检验机构检验。
复核检验机构应当严格按照申请材料中的测定方法以及相关说明进行操作,对测定方法的科学性、复现性、适用性进行验证,对产品质量可控性进行复核检验,并应当自接受委托之日起60个工作日内完成复核检验,将复核检验报告送交审评机构。
③补充材料时限
涉及注册申请人补充材料的,审评中心收到补充材料后,审评时间重新计算。
按要求补充材料的,注册申请人及时凭受理编号和登录密码领取电子审评意见通知书后,应按要求逐项顺序提交补充材料,完成网上填报。提交补充资料时,应将该项目修改后的完整资料一并提供,加盖与原注册申请人一致的公章。自发放《审评意见通知书》电子审评意见后5个工作日开始计时,注册申请人应在3个月内一次提交补充材料。
④报送审评结论和建议时限
审评机构作出综合审评结论及建议后,应当在5个工作日内报送国家市场监督管理总局。
3、审批阶段
①做出审批决定时限
国家市场监督管理总局应当自受理之日起20个工作日内对审评程序和结论的合法性、规范性以及完整性进行审查,并作出准予注册或者不予注册的决定。
②告知申请人审批决定时限
国家市场监督管理总局作出准予注册或者不予注册的决定后,应当自作出决定之日起10个工作日内,由受理机构向注册申请人发出保健食品注册证书或者不予注册决定。
表2是对整个保健食品注册流程所需时限的汇总:
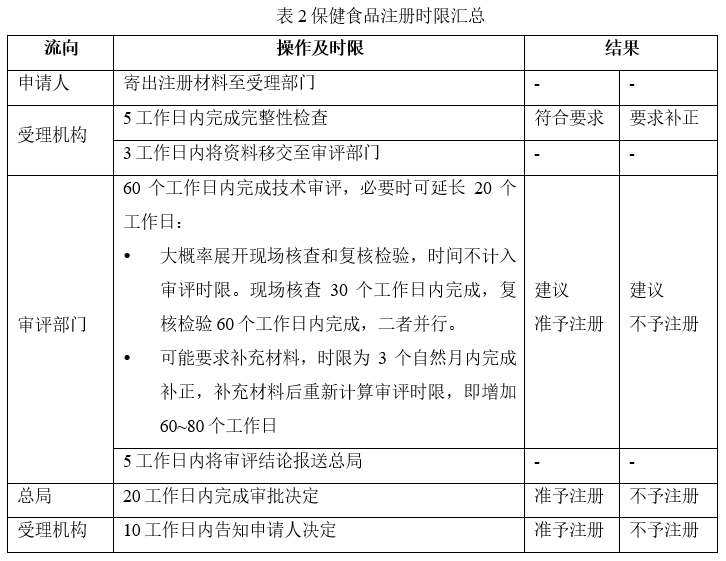
根据表2,最理想的情况就是审批阶段就是不进行现场核查、复核检验,且不补充材料,则总时长为133个工作日(约6个自然月),当然这是小概率事件。而据此得到的最长时限是293个工作日+3个自然月(总计约16个自然月)
(四)总结
进一步,将从研发到获批整个流程所需的弹性时间和硬性时间汇总如下:
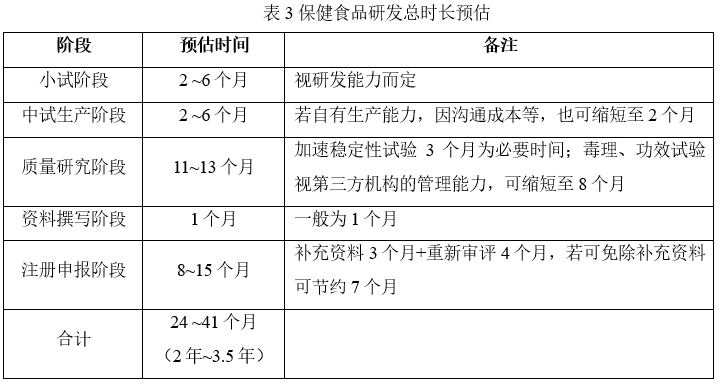
从表3可知,保健食品整个研发流程的时间大概在2年~3.5年。
自2023年发布的新规,无疑为保健食品注册申请注入了活力,但是我们也不得不面对一个现实:2023年新规前堆积而未获批的资料,2023年新规后涌入的大量新申报资料。退一步说,即使当前的审评分为新旧两条通路,互不干扰,但是保健食品在不收取注册费用的前提,需要开展资料审评、现场核查、复核检验等工作,在人员编制、经费有限的情况下,“旧资料”在一定程度上仍会影响新注册申报的速度。在当前仿制药研发式微,大健康行业趋热的大背景下,是否入场保健食品注册研发仍需各公司机构谨慎考虑,本文或可在时间成本上提供一定参考。
参考资料:
[1]对于功能学评价试验先后顺序的要求 (cfe-samr.org.cn)
[2] 保健食品注册与备案管理办法
[3]保健食品注册申请服务指南(2016版)
[4] 保健食品注册审评审批工作细则(2016年版)
[5]使用保健食品原料目录以外原料和首次进口的保健食品(除属于补充维生素、矿物质等营养物质外)注册实施规范(基本要素)








