 2023-11
2023-11官网栏目介绍
主要分为9个栏目,如新闻中心、政策法规、申请人之窗等,首页也根据关注度,设有热点专题,如儿童用药专栏、优先审评公示、指导原则专栏等。
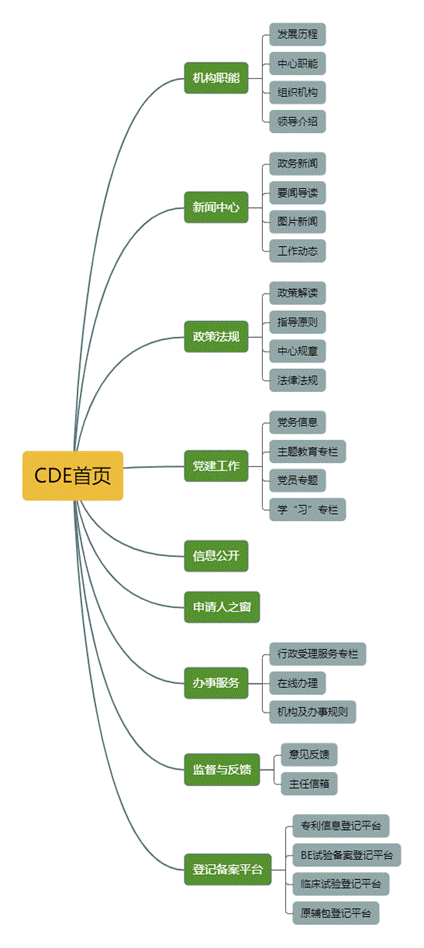
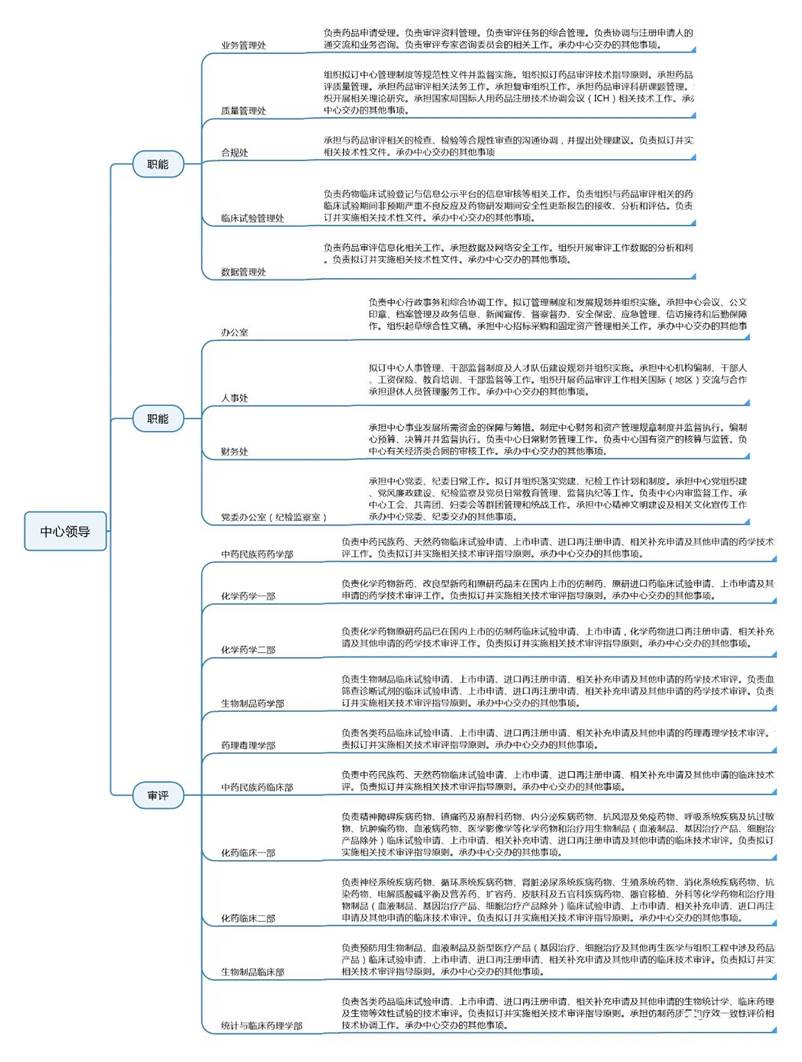
一、机构职能
公众可在这里了解CDE的概况。
二、新闻中心
该栏目分四个子栏目,最需要经常关注下的就是“工作动态”一栏。该部分通常也会有一些指导原则征求意见稿及正式稿、参比制剂公式、线上培训等内容和我们的日常工作息息相关,作为日常学习查漏补缺的一部分。
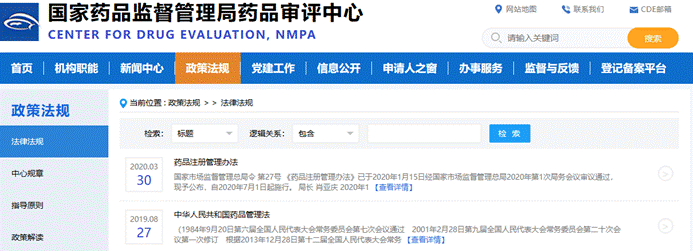
三、政策法规
企业可在政策法规栏目获取最新的政策法规,中心规章主要侧重CDE审评期间与过程中的工作流程与程序,囊括了药学研究需要重点关注的指导原则、药政法规,需要我们融会贯通,应对该专栏中的指导原则下载分类管理,吃透的同时,在需要法规论据的时候,能够及时找到解决药品开发过程中遇到的各种法规问题。
四、信息公开
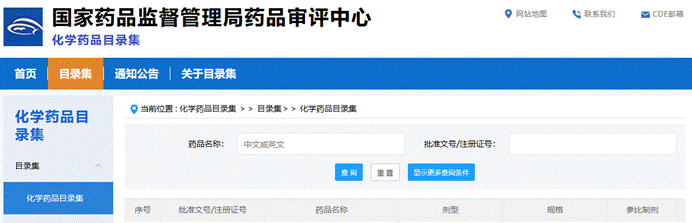
企业可在该栏目的子栏目下,输入药品名称或受理号等相关信息进行查询公开内容,也是CDE的数据库干货集中营,汇集了官方数据库信息(包含了受理品种信息、上市药品信息、原辅包登记信息、药品目录集信息等),信息公示类(审评任务公示、沟通交流公示、优先审评公示、突破性治疗公示、三合一序列公示等)、特殊审批品种列表、临床试验默许许可、送达信息、共性问题、重点工作等。其中无参比制剂的预期临床价值评估的III类会议在“沟通交流公示”处。

另外药品目录集信息,CDE专门设立了一个专栏,此为中国版的orange book。此处可以查询最新批准的药品和说明书(部分)。
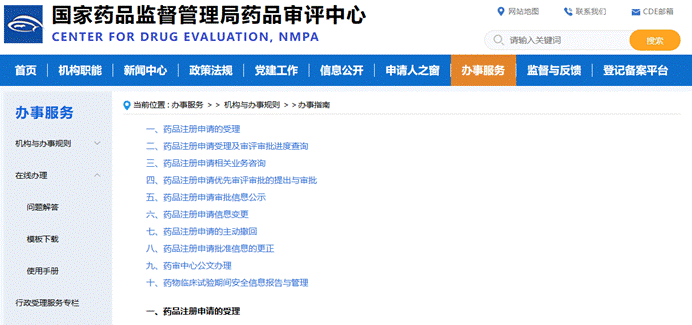
五、办事服务
该栏目主要提供给企业查询办事指南及模版下载。
六、申请人之窗及登记备案平台
申请人之窗企业可使用UKey登录,进行网上办事申请及查询;登记备案平台设有四个子栏目(原辅包登记平台、临床试验登记平台、BE备案登记平台、专利信息登记平台),如企业进行信息查询无需登录,如企业进行网上办事可使用UKey登录办理。

免责声明:如涉及作品内容、版权和其它问题,请跟我们联系删除!








