 2023-08
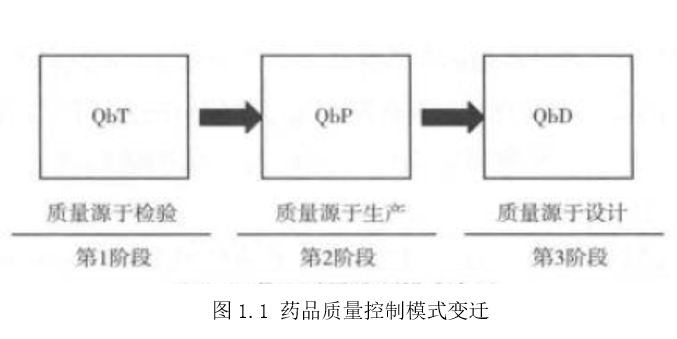
2023-08当人们已经普遍接受药品质量是生产出来的而不是检验出来这一质量理念之后,近年来已推行质量源于设计(Quality by Design ,QbD)即如图1.1所示的药品质量控制模式变迁。从图1.1中可以看出质量源于检验(QbT)专注于对产品质量仅进行终点(成品)检测,滞后且属于单点控制,经常失败且成本高。将控制重心前移至生产阶段,即为质量源于生产(QbP)。该模式强调过程控制为事中、同步和多点控制,又增加书面记录系统,对产品质量有一定保障。将控制重心再前移至设计(研发)阶段,即为质量源于设计 (QbD)。该模式为事前控制,产品的质量、有效性和安全性由设计(研发)所赋予或融人到产品和工艺中,当属最先进和最有效的质控模式。
所谓药品QbD,按照ICH Q8(R2)的定义就是:在充分的科学知识和风险评估基础之上,始于预先设定的目标,并强调对产品与工艺的理解及过程控制的一种系统化方法。实施QbD的理想状态是:不需要药政部门过多的监管,能持续可靠且高效灵活地生产出高质量的产品。按此定义进行的药品研发和生产等活动统称为QbD方法,以与传统方法相区别。
QbD是一种基于风险预防和控制的药物开发方法,它可以应用于处方工艺开发中,提供有效的路径和方法。QbD的概念最早由美国FDA(美国食品药品监督管理局)提出,并在药物开发和生产中得到广泛应用。实施QbD,有助于全面提升药品质量和药品研发水平。
QbD的核心原则包括:明确目标产品质量要求、理解和控制关键质量属性、设计合理的工艺路线和操控空间、建立可靠的控制策略和监测方法。
QbD的应用可以提高药物开发的效率和质量,减少生产过程中的变异性和风险。
QbD的方法包括质量风险评估、设计实验、多变量数据分析等。
QbD的应用还可以促进药物生产的持续改进和优化,提高产品的一致性和可靠性。
在ICH Q8中定义了常用的QbD元素,包括:
1)药品QbD的基本内容是明确目标产品的质量概况(QTPP):在处方工艺开发中,首先需要明确目标产品的质量概况,即确定目标产品的关键质量属性(CQA)。这些CQA是根据目标产品的质量要求和药物特性来确定,例如溶解度、稳定性、纯度等。QbD的理念强调在工艺开发的早期阶段就要明确这些质量要求,以便在后续的工艺设计和优化中有针对性地进行。
2)设计合理的工艺路线:QbD要求在处方工艺开发中设计合理的工艺路线。这意味着工艺路线必须是科学可行的,并且具备可控性和合理性。科学可行性是指工艺路线必须基于科学原理,并且经过充分的文献检索和理论分析来验证。可控性是指工艺的反应条件和结果在不同批次之间具有重现性,并且符合质量控制要求。合理性是指工艺路线需要满足工业化的要求,包括原材料、设备、工艺条件等方面的考虑。此外,工艺路线的设计还需要考虑环境污染、健康安全和成本等因素。确定关键工艺参数(CPP)和关键物料属性(CMA):在处方工艺开发中,QbD要求确定关键工艺参数(CPP)和关键物料属性(CMA)。这些参数和属性的波动或变化对目标产品的关键质量属性(CQA)有显著影响。通过对这些关键参数和属性进行评估和控制,可以确保产品的一致性和质量稳定性。
3)设计合理的工艺操控空间:QbD要求在处方工艺开发中设计合理的工艺操控空间。工艺设计空间是指在小试、中试和预期商业化生产规模下,对工艺特性进行研究和评估,并制定合理的工艺参数和质量标准参数。通过合理的工艺操控空间设计,可以确保工艺的可控性和一致性,从而保证产品的质量。
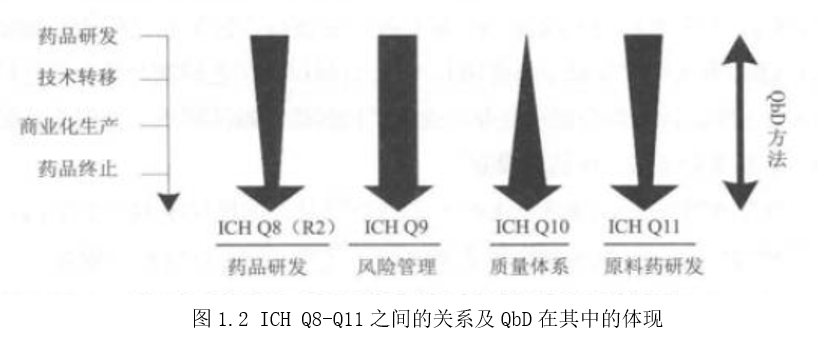
QbD方法的具体应用集中体现在ICH质量体系指导原则Q8-Q11中。因此将4个指导原则合称为QbD系列指导原则。ICH Q8-Q11指导原则之间的关系及 QbD在其中的体现。
ICH Q8-Q11系列指导原则所提供的全新质量范例创立了一个和谐完整的药品质量体系,该体系强调风险管理与科学知识一体化,并贯穿于整个产品和工艺生产周期,以实现持续改进。研发和生产中所获得的信息(ICH Q8、Q10、Q11和GMP)是风险评估(ICH Q9)的基础,必须用风险管理来评估和控制潜在的风险物料属性和工艺参数,从而建立并实施合适的控制策略。另一方面,药品质量体系(ICH Q10)又贯穿于从产品研发到终止的整个生命周期中,整体上控制研发(ICH Q11),生产(GMP)和风险管理((ICH Q9)的有效实施。ICH Q8-Q11和QbD系列指导原则之间的关系及QbD在其中的体现见图1.2。
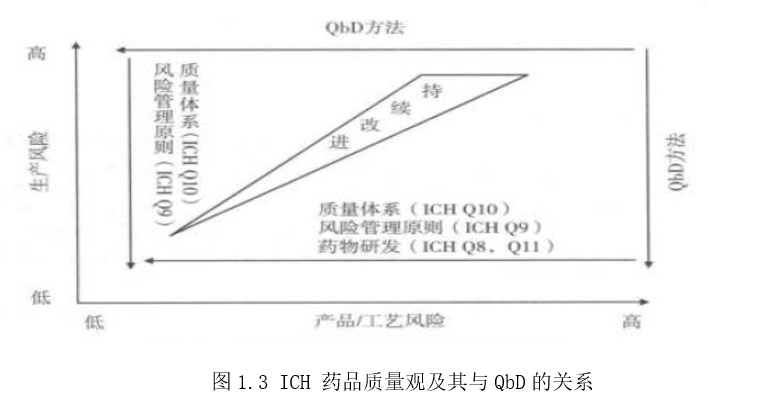
ICH Q8-Q11和QbD系列指导原则是一个密切相关和不可分割的整体。4大指导原则有机地组合在一起,构成旨在全面提升产品质量和有效降低各类风险的ICH完整的药品质量观。
综上所述,QbD理念的应用可以在处方工艺开发中提供有效的路径和方法,帮助明确目标产品的质量要求,设计合理的工艺路线和操控空间,并确保关键工艺参数和物料属性的控制,从而实现处方工艺的优化和质量的稳定性。
参考文献:
【1】QbD与药品研发:概念和实例/王兴旺编著。-北京:知识产权出版社,2014.11 ISBN 978-7-5130-2835-6
【2】周海钧,等译.药品注册的国际技术要求(质量部分).北京:人民卫生出版社,2011
【3】FDA发布Quality by Design for ANDAs:An Example for Modified Release Dosage Forms
【4】ICH Quality Implementation Working Group. Points to consider (R2). ICH-Endorsed Guide for ICH Q8/Q9/Q10 Implementation. 6 December, 2011.








