 2022-11
2022-11前言
根据《国家药监局关于实施药品注册管理办法>有关事宜的公告》(2020年第46号),2020年7月国家药监局药审中心关于发布《化学药品注册受理审查指南(试行)》的通告(2020年第10号),自发布之日起,化学药品4类申报按照《化学药品注册受理审查指南(第二部分 注册分类3、4、5.2类)(试行)》执行。
本文主要从注册申请资料提交方面进行简单介绍。
一、申报资料的准备
(1)基本要求
根据现行版《M4:人用药物注册申请通用技术文档(CTD)》格式整理,目录及项目编号不能改变,对应项目无相关信息或研究资料,项目编号和名称也应保留,可在项下注明“不适用”并说明理由。
★关注点★
过往仿制药可以按照CDE发布的《关于发布化学药品新注册分类申报资料要求(试行)的通告(2016年第80号)》,但从2020年第10号文发布新的注册受理审查指南开始,仿制药的申请人应该按照ICH要求,根据M4目录结构来进行相关资料递交,而80号文格式目前仅适用于补充申请(例如一致性评价)。
(2)提交资料的数量
2套完整申请资料(至少1套为原件)+1套综述资料(应包含模块一、模块二),每套装入相应的申请表及目录。
★关注点★
建议申请人不要额外多提交申请资料份数,并非说提交的数量越多越好,只需要根据要求提供即可,如超过数量可能还会被作销毁处理。
二、电子资料的准备
如果申请人不是通过eCTD提交,而是仍然使用传统的纸质版提交方式,应按照CDE 2022年1月29日发布的《药审中心关于疫情期间调整受理工作方式及接收申报资料要求的通知》要求先提交电子申报资料光盘至受理中心,待光盘资料形式审查通过后再邮件纸质版申报资料。
★关注点★
①光盘邮寄前依然要按照要求发送邮件至CDE的邮箱zlyb@cde.org.cn。
②电子光盘档案袋封面应使用“业务应用系统”中的档案袋封面模板。如下图

③电子版光盘资料除了申报的全套文件外,还应在光盘的根目录下放入电子申报资料承诺书。如下图

三、电子光盘技术要求
根据国家药监局药审中心关于发布《药品注册申报资料格式体例与整理规范》的通告(2020年第12号)的相关要求进行整理。
★关注点★
①电子光盘应使用一张大容量光盘而非多张小容量。
②电子版提交的文件只有两种格式:PDF格式或SAS XPORT 传输文件(主要是临床数据库文件)。申请人提交时不要提交WORD版格式文件,因为不同WORD版本可能会不兼容,有可能出现格式错乱导致出现阅读困难的问题。
②对于提交的扫描版的PDF文件,应启动光学字符识别(OCR)功能,确保内容可复制、可搜索。单个PDF文件控制在500M以内。文件不得压缩和加密(加密的电子参考文献除外)。
③文件名称仅允许使用汉字、英文字母“a至z”、数字0至9、中划线“-”和下划线“_”。由于各家计算机版本不一致,因此某些软件版本的字符在低版本无法兼容正确显示,因此需要按照较为低级软件版本要求执行。
④由根目录文件夹开始的所有文件夹和文件名(含扩展名)路径长度不应超过180个字符,单一文件夹或文件名称(含扩展名)长度不应超过64个字符(32个汉字)。此项尤其需要注意参考文献命名,有些文献名称过长有可能导致无法正确显示。
四、纸质资料提交要求
★关注点★
①按照要求发送邮件至CDE的专用邮箱zlyb@cde.org.cn时,至少在邮寄包裹到达CDE的前一工作日下午16:00前发送邮件,否则会被拒收邮寄包裹。
另外如果条件允许,可与快递沟通尽量在早上安排快递的送达,否则有可能由于某天CDE中心快递太多无法存放而需要第二天再次派送的情况。
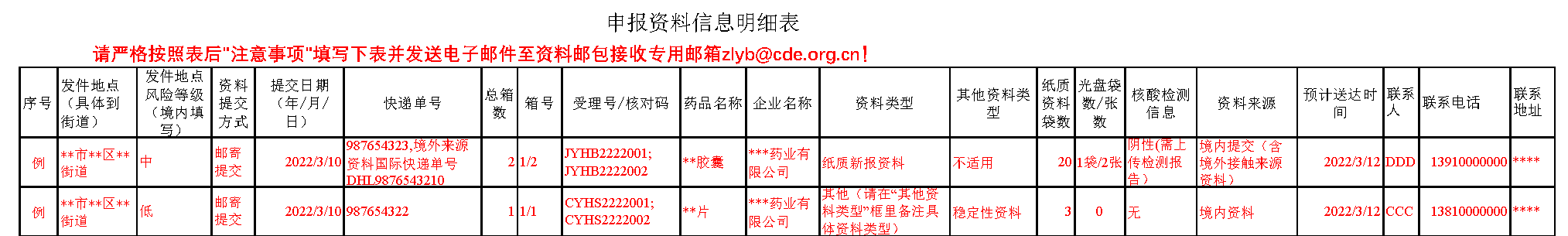
②邮件标题格式:“快递单号+【箱数】”,如有多个快递单号,中间以分号隔开。《申报资料信息明细表》中每个快递单号对应一行,邮寄单号必须准确(如果包含字母的也需要写上)。注意境外资料及高风险地区还需要提供快递核酸检测报告。如下图
③每个档案盒的封面应使用“业务应用系统”中的档案袋封面模板。封面模板一适用于第一套原件资料,横向打印,粘贴时应将分隔线以左的部分贴于档案袋左侧;封面模板二适用于第二套、第三套复印件资料,纵向打印,粘贴时应将分隔线以下的部分贴于档案袋底部。如下图

④纸质版提交时候需要同时邮寄临床试验数据库光盘一式两张,放在第一套第一袋中即可。数据库光盘盒子面写明项目名称、申请事项、受理号、申请人,并盖上公章。








